第二部分(非選擇題共174分
22.(請在答題卡上作答)(17分)
(1) 在“描繪小燈泡的伏安特性曲線”實驗中.用導線a、b、c、d、e、f、g和h按題22圖1所示方式連接電路,電路中所有元器件都完好,且電壓表和電流表已調零.閉合開關后;
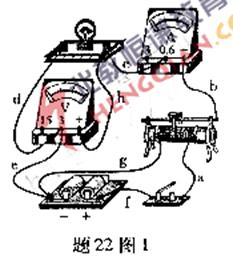
①若電壓表的示數為2 V,電流表的的示數為零,小燈泡不亮,則斷路的導線為_________;
②若電壓表的示數為零,電流表的示數為0.3 A,小燈泡亮,則斷路的導線為_________;
③若反復調節滑動變阻器,小燈泡亮度發生變化,但電壓表、電流表的示數不能調為零,則斷路的導線為____________.
(2)建造重慶長江大橋復線橋高將長百米、重千余噸的鋼梁從江水中吊起(題22圖2)、施工時采用了將鋼梁與水面成一定傾角出水的起吊方案,為了探究該方案的合理性,某研究性學習小組做了兩個模擬實驗.研究將鋼板從水下水平拉出(實驗1)和以一定傾角拉出
(實驗2)的過程中總拉力的變化情況.
①必要的實驗器材有:鋼板、細繩、水盆、水、支架、刻度尺、計時器和 等.
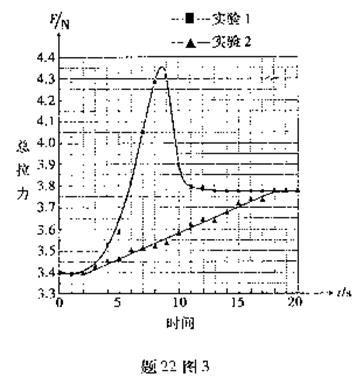
②根據實驗曲線(題22圖3),實驗2中的最大總拉力比實驗1中的最大總拉力降低了 .
③ 根據分子動理論,實驗1中最大總拉力明顯增大的原因是 .
④ 可能導致測量拉力的實驗誤差的原因有:讀數不準、鋼板有油污、 等等(答出兩個即可)
23.(16分)t=0時,磁場在xOy平面內的分布如題23圖所示.其磁感應強度的大小均為B0,方向垂直于xOy平面,相鄰磁場區域的磁場方向相反.每個同向磁場區域的寬度均為l0.整個磁場以速度v沿x軸正方向勻速運動.
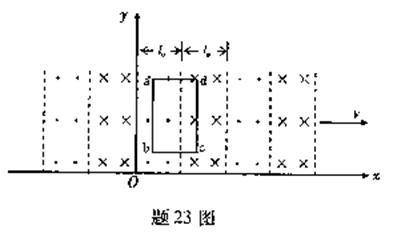
(1)若在磁場所在區間,xOy平面內放置一由a匝線圈串聯而成的矩形導線框abcd,線框的bc邊平行于x軸.bc=lB、ab=L,總電阻為R,線框始終保持靜止.求
①線框中產生的總電動勢大小和導線中的電流大小;
②線框所受安培力的大小和方向.
(2)該運動的磁場可視為沿x軸傳播的波,設垂直于紙面向外的磁場方向為正,畫出L=0時磁感應強度的波形圖,并求波長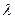 和頻率f.
和頻率f.
24.(9分)飛行時同質譜儀可通過測量離子飛行時間得到離子的荷質比q/m.如題24圖1,帶正電的離子經電壓為U的電場加速后進入長度為L的真空管AB,可測得離子飛越AB所用時間L1.改進以上方法,如圖24圖2,讓離子飛越AB后進入場強為E(方向如圖)的勻強電場區域BC,在電場的作用下離子返回B端,此時,測得離子從A出發后飛行的總時間t2,(不計離子重力)
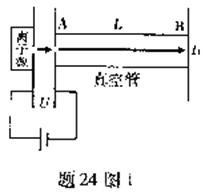
(1)忽略離子源中離子的初速度,①用t1計算荷質比;②用t2計算荷質比.
(2)離子源中相同荷質比離子的初速度不盡相同,設兩個荷質比都為q/m的離子在A端的速度分別為v和v′(v≠v′),在改進后的方法中,它們飛行的總時間通常不同,存在時間差Δt.可通過調節電場E使Δt=0.求此時E的大小.
25.(20分)某興趣小組設計了一種實驗裝置,用來研究碰撞問題,其模型如題25圖所示不用完全相同的輕繩將N個大小相同、質量不等的小球并列懸掛于一水平桿、球間有微小間隔,從左到右,球的編號依次為1、2、3……N,球的質量依次遞減,每球質量與其相鄰左球質量之比為k(k<1 .將1號球向左拉起,然后由靜止釋放,使其與2號球碰撞,2號球再與3號球碰撞……所有碰撞皆為無機械能損失的正碰.(不計空氣阻力,忽略繩的伸長,
.將1號球向左拉起,然后由靜止釋放,使其與2號球碰撞,2號球再與3號球碰撞……所有碰撞皆為無機械能損失的正碰.(不計空氣阻力,忽略繩的伸長,
g取10 m/s2)
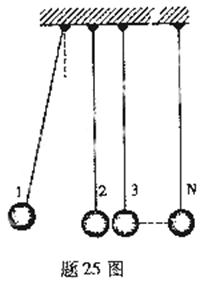
(1)設與n+1號球碰撞前,n號球的速度為vn,求n+1號球碰撞后的速度.
(2)若N=5,在1號球向左拉高h的情況下,要使5號球碰撞后升高16k(16 h小于繩長)問k值為多少?
26.(14分)脫除天然氣中的硫化氫既能減少環境污染,又可回收硫資源.
(1)硫化氫與FeCl3溶液反應生成單質硫,其離子方程式為 .
(2)用過量NaOH溶液吸收硫化氫后,以石墨作電極電解該溶液可回收硫、其電解總反應方程式(忽略氧的氧化還原)為 ;該方法的優點是 .
(3)一定溫度下1 mol NH4 HS固體在定容真空容器中可部分分解為硫化氫和氨氣.
①當反應達平衡時ρ氨氣×p硫化氫=a(Pa2),則容器中的總壓為 Pa;
②題26圖是上述反應過程中生成物濃度隨時間變化的示意圖.若t2時增大氨氣的濃度且在t3時反應再次達到平衡,諸在圖上畫出t2時刻后氨氣、硫化氫的濃度隨時間的變化曲線.
方案 | 反應物 |
甲 | Cu、濃HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
27.(16分)某興趣小組設計出題27圖所示裝置來改進教材中“銅與硝酸反應”實驗,以探究化學實驗的綠色化.
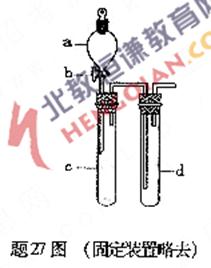
(1)實驗前,關閉活塞b,試管d中加水至浸沒長導管口,塞緊試管c和d的膠塞,加熱c.其目的是 .
(2)在d中加適量NaOH溶液,c中放一小塊銅片,由分液漏斗a向c中加入2 mL濃硝酸.c中反應的化學方程式是 .再由a向e中加2 mL蒸餾水,c中的實驗現象是 .
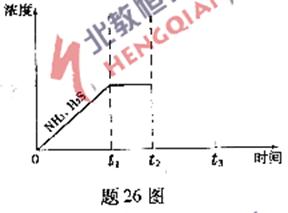
(3)題27表是制取硝酸銅的三種方案,能體現綠色化學理念的最佳方案是 .
再由a向c中加2 mL蒸餾水,c中的實驗現象是 .
(4)該小組還用上述裝置進行實驗證明氧化性KMnO4>Cl2>Br2.操作步驟為 ,
實驗現象為 ;但此實驗的不足之處是 .
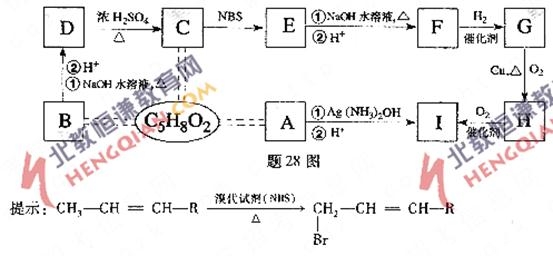
28.(16分)有機物A、B、C互為同分異構體,分子式為C5H8O2,有關的轉化關系如題28圖所示,已知:A的碳鏈無支鏈,且1 mol A 能與4 mol Ag(NH3)2OH完全反應;B為五元環酯.
提示:
(1)A中所含官能團是 .
(2)B、H結構簡式為 .
(3)寫出下列反應方程式(有機物用結構簡式表示)
E→C ;
E→F .
(4)F的加聚產物的結構簡式為 .
29.(14分)a、b、c、d、e是短周期元素,周期表中a與b、b與c相鄰;a與c的最外層電子數之比為2∶3,b的最外層電子數比c的最外層電子數少1個;常見化合物d2c2與水反應生成c
的單質,且溶液使酚酞試液變紅.
(1)e的元素符號是 .
(2)a、b、c的氫化物穩定性順序為(用分子式表示) ;b的氫化物和b的最高價氧化物的水化物反應生成Z,則Z中的化學鍵類型為 ,Z的晶體類型為 ;ab-離子的電子式為 .
(3)由a、c、d形成化合物的水溶液顯堿性,其原因是(用離子方程式表示) .
(4)一定量的d2c2與ac2反應后的固體物質,恰好與0.8 mol稀鹽酸溶液完全反應,并收集到0.25 mol氣體,則用物質的量表示該固體物質的組成為 .
30.(21分)李振聲院士獲得了2006年度國家最高科技獎,其主要成就是實現了小麥同偃麥草的遠緣雜交,培合出了多個小偃麥品種.請回答下列有關小麥遺傳育種的問題:
(1)如果小偃麥早熟(A)對晚熟(a)是顯性,抗干熱(B)對不抗干熱(b)是顯性(兩對)基因自由組合,在研究這兩對相對性狀的雜交試驗中,以某親本與雙隱性純合子雜交,F1代性狀分離比為1∶1,請寫出此親本可能的基因型: .
(2)如果決定小偃麥抗寒與不抗寒的一對基因在葉綠體DNA上,若以抗寒晚熟與不抗寒早熟的純合親本雜交,要得到抗寒早熟個體,需用表現型為 本,該純合的抗寒早熟個體最早出現在 代.
(3)小偃麥有藍粒品種,如果有一藍粒小偃麥變異株,籽粒變為白粒,經檢查,體細胞缺少一對染色體,這屬Ⅰ染色體變異中的 變異.如果將這一變異小偃麥同正常小偃麥雜交得到的F1代自交,請分別分析F2代中出現染色體數目正常與不正常個體的原因: .
(4)除小偃麥外,我國也實現了普通小麥與黑麥的遠緣雜交.
①普通小麥(六倍體)配子中的染色體數為21,配子形成時處于減數第二次分裂后期的每個細胞中的染色體數為 ;
②黑麥配子中的染色體數和染色體組數分別為7和1,則黑麥屬于 倍體植物.
③普通小麥與黑麥雜交,F1代體細胞中的染色體組數為 ,由此F1代可進一步育成小黑麥.
31.(21分)甘薯和馬鈴薯都富含淀粉,但甘薯吃起來比馬鈴薯甜.為探究其原因,某興趣小組以甘薯塊莖為材料,在不同溫度、其他條件相同的情況下處理30 min后測定還原糖含量.結果表明馬鈴薯不含還原糖,甘薯的還原糖含量見下表:
處理溫度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
甘薯還原糖含量(mg/g) | 22.1 | 23.3 | 25.8 | 37.6 | 40.5 | 47.4 | 54.7 | 68.9 | 45.3 | 28.6 |
(1)由表可見,溫度為70 ℃時甘薯還原糖含量最高,這是因為 .
(2)馬鈴薯不含還原糖的原因是 .
(3)為了確認馬鈴薯不含還原糖的原因,請完成以下實驗:
實驗原理:① ;
② .
備選材料與用具:甘薯提取液(去淀粉和還原糖),馬鈴薯提取液(去淀粉)二苯胺試劑,芝林試劑,雙縮脲試劑,質量分數為3%的淀粉溶液為3%的淀粉溶液和質量分數為3%的蔗糖溶液等.
實驗步驟:
第一步:取A、B兩支試管,在A管中加入甘薯提取液,B管中加入等量的馬鈴薯提取液.
第二步:70 ℃水浴保溫5 min后,在A、B兩支試管中各加入 .
第三步:70 ℃水浴保溫5 min后,在A、B兩支試管中各加入 .
第四步: .
實驗結果: .
(4)馬鈴薯不含還原糖,但吃起來略帶甜味,這是由于
的作用,食用馬鈴薯后消化分解成的葡萄糖、被小腸上皮細胞吸收后發生的代謝變化是











