第I卷
1.化學與生產、生活息息相關, 下列敘述錯誤的是
A.鐵表而鍍鋅可以增強其抗腐蝕性
B.用聚乙烯塑料代替聚乳酸塑料可減少白色污染
C.大量燃燒化石燃料是造成霧霾天氣的一種重要因素
D.含再金屬離子的電鍍廢液不能隨意排放
2.實驗室制備下列氣體時,所用方法正確的是
A.制氧氣時,用Na2O2或H2O2作反應物可選擇相同的氣體發生裝置
B.制氯氣時,用飽和NaHCO3溶液和濃硫酸凈化氣體
C.制乙烯時,用排水法或向上排空氣法收集氣體
D.制二氧化氮時,用水或NaOH溶液吸收尾氣
3.運用相關化學知識進行判斷,下列結論錯誤的是
A.某吸熱反應能自發進行,因此該反應是熵增反應
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃試劑瓶中
C.可燃冰主要甲烷與水在低溫高壓下形成的水合物晶體,因此可存在于海底
D.增大反應物濃度可加快反應速率,因此用濃硫酸與鐵反應能增大生成H2的速率
4.對右圖兩種化合物的結構或性質描述正確的是
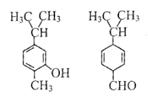
A.不是同分異構體
B.分子中共平面的碳原了數相同
C.均能與溴水反應
D.可用紅外光譜區分,但不能用核磁共振氫譜區分
5.下列有關電解質溶液中粒子濃度關系正確的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
B.含有AgCl和AgI固體的懸濁液:c(Ag+)>c(C1-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物質的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
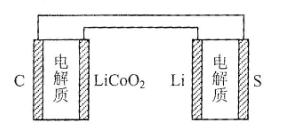
6.已知:鋰離子電池的總反應為:LixC+Li1-xCoO2放電充電C+LiCoO2,鋰硫電池的總反應為:2Li+S放電充電Li2S,有關上述兩種電池說法正確的是
A.鋰離子電池放電時,Li+向負極遷移
B.鋰硫電池充電時,鋰電極發生還原反應
C.理論上兩種電池的比能量相同
D.右圖表示用鋰離子電池給鋰硫電池充電
第II卷
7.(14分)元素單質及其化合物有廣泛用途,請根據周期表中第三周期元素相關知識回答下列問題:
(1)按原子序數遞增的順序(稀有氣體除外),以下說法正確的是 ___________ 。
a.原子序數和離子半徑均減小 b.金屬性減弱,非金屬性增強
c.氧化物對應的水合物堿性減弱,酸性增強 d.單質的熔點降低
(2)原子最外層電子數與次外層電子數相同的元素名稱為 ___________,氧化性最弱的簡單陽離子是___________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
類型 | 離子化合物 | 離子化合物 | 離子化合物 | 共價化合物 |
熔點/℃ | 2800 | 2050 | 714 | 191 |
工業制鎂時,電解MgCl2而不電解MgO的原因是___________;制鋁時,電解Al2O3而不電解AlCl3的原因是___________。
(4)晶體硅(熔點1410℃)是良好的半導體材料。由粗硅制純硅過程如下:
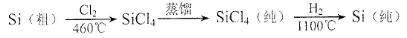
寫出SiCl4的電子式:___________;在上述由SiCl4制純硅的反應中,測得每生成1.12kg純硅需吸收akJ熱量,寫出該反應的熱化學方程式:___________。
(5)P2O5是非氧化性干燥劑,下列氣體不能用濃硫酸干燥,可用P2O5干燥的是 ___________。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于實驗室制O2,若不加催化劑,400℃時分解只生成兩種鹽,其中一種是無氧酸鹽,另一種鹽的陰陽離子個數比為1:1。寫出該反應的化學方程式:___________。
8.(18分)從薄荷油中得到一種烴A(C10H16),叫ɑ—非蘭烴,與A相關反應如下:
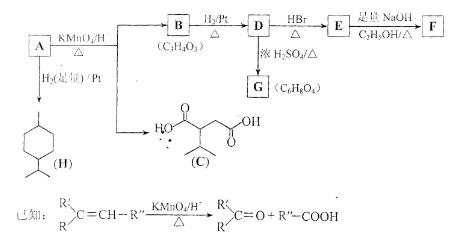
(1)H的分子式為 ___________。
(2)B所含官能團的名稱為___________ 。
(3)含兩個—COOCH3基團的C的同分異構體共有___________ 種(不考慮手性異構),其中核磁共振氫譜呈現2個吸收峰的異構體結構簡式為 ___________。
(4)B→D,D→E的反應類型分別為___________ 、___________。
(5)G為含六元環的化合物,寫出其結構簡式:___________ 。
(6)F在一定條件下發生聚合反應可得到一種高級吸水性樹脂,該樹脂名稱為___________。
(7)寫出E→F的化學方程式:_________________________________ 。
(8)A的結構簡式為 ___________,A與等物質的量的Br2進行加成反應的產物共有___________ 種(不考慮立體異構)。
9.(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或堿性環境中穩定。
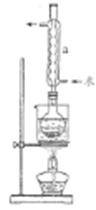
I.制備Na2S2O3•5H2O
反應原理:Na2SO3(aq)+S(s)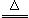 Na2S2O3(aq)
Na2S2O3(aq)
實驗步驟:
①稱取15g Na2SO3加入圓底燒瓶中,再加入80ml蒸餾水。另取5g研細的硫粉,用3ml乙醇潤濕,加入上述溶液中。
②安裝實驗裝置(如圖所示,部分加持裝置略去),水浴加熱,微沸60分鐘。
③趁熱過濾,將濾液水浴加熱濃縮,冷卻析出Na2S2O3•5H2O,經過濾,洗滌,干燥,得到產品。
回答問題:
(1)硫粉在反應前用乙醇潤濕的目的是___________。
(2)儀器a的名稱是___________,其作用是___________ 。
(3)產品中除了有未反應的Na2SO3外,最可能存在的無機雜質是___________,檢驗是否存在該雜質的方法是___________。
(4)該實驗一般控制在堿性環境下進行,否則產品發黃,用離子方程式表示其原因:___________ .
II.測定產品純度
準確稱取Wg產品,用適量蒸餾水溶解,以淀粉作指示劑,用0.1000 mol•L‾1碘的標準溶液滴定。反應原理為:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至終點時,溶液顏色的變化:___________________。
(6)滴定起始和終點的液面位置如圖,則消耗碘的標準溶液體積為_________mL。產品的純度為(設Na2S2O3•5H2O相對分子質量為M)_________ 。

III.Na2S2O3的應用
(7)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42‾,常用作脫氧劑,該反應的離子方程式為 ___________________。
10.(14分)合成氨是人類科學技術上的一項重大突破,其反應原理為:N2(g)+3H2(g)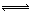 2NH3(g) ∆H=—92.4kJ•mol‾1,一種工業合成氨的簡易流程圖如下:
2NH3(g) ∆H=—92.4kJ•mol‾1,一種工業合成氨的簡易流程圖如下:
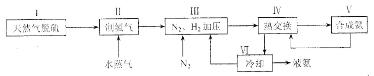
(1)天然氣中的H2S雜質常用常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式:___________________。
(2)步驟II中制氯氣原理如下:
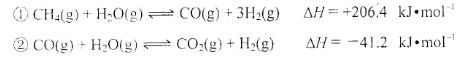
對于反應①,一定可以提高平衡體系中H2百分含量,又能加快反應速率的是___________________。
a.升高溫度 b.增大水蒸氣濃度 c.加入催化劑 d.降低壓強
利用反應②,將CO進一步轉化,可提高H2產量。若1mol CO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18mol CO、CO2和H2的混合氣體,則CO轉化率為 ___________________。
(3)圖1表示500℃、60.0MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:___________________。
(4)依據溫度對合成氨反應的影響,在圖2坐標系中,畫出一定條件下的密閉容器內,從通入原料氣開始,隨溫度不斷升高,NH3物質的量變化的曲線示意圖。
(5)上述流程圖中,使合成氨放出的熱量得到充分利用的主要步驟是(填序號)___________________,簡述本流程中提高合成氨原料總轉化率的方法:___________________ 。











